联系地址:四川省成都市青羊区腾飞大道189号F区15栋9楼
服务热线:028-81717728
[Summary]成功或许难以再复制,但是失败却有规律可循。
对中国的医药行业来说,2015年大刀阔斧的除冗破旧,一笔划下了中国新药研发的新时代与旧时代的分隔线。
如果说研发1.0是进行大量的仿制,积累原始资本;研发2.0则是me-too跟进,对海外既往十年的药物进行“fast-follow”,
吸引资本涌入的同时也埋下了同质化的隐患;而在医保控费和同质产品成本战的双层夹攻之下,出海似乎成为破局途径之一。
成功案例自然有,但被这滔滔大浪打翻的梦想之船更不在少数。成功或许难以再复制,但是失败却有规律可循。
1
逐利或求生存,扬帆起航
有目共睹,中国的医药市场规模正在迅速增长,不过与高度资本化的美国市场相比,国内目前的支付能力暂时还无法孵化出
超10亿美元的重磅药物——根据2021年的最新数据,中美医疗费用支出仍有3.9倍差距,人均医疗费用相差16.6倍。
2020年,中国的处方药市场规模约1.2万亿元,此时全球的处方药市场规模约5.8万亿元。乍一看比重尚可,但一旦剔除掉
中成药和仿制药的规模,比重立刻从20%下降到1.2%。
从各种跨国巨头药企的财报表中,这一处境也得到显露。2021年阿斯利康中国区收入为60亿美元,位居MNC中国区收入的
头把交椅。可纵向看,相对它全年的收入374.17亿元,中国市场收入仅占16%,美国市场约占32%。在2021年全球药企收入
排名榜单中,阿斯利康居于第十,以此类推,在诸如强生、辉瑞、罗氏等企业中,中国市场在总收入的占比更低。
再换一个纬度来对比,以恒瑞医药为例,其2021年全年营收为259亿元,而艾伯维的“常青树”修美乐那一年卖了206.96亿
美元(1398亿元),换言之,修美乐一年创造的收入就是恒瑞医药一年收入的5倍。这就是重磅药物的力量。
如果以上是外部市场的诱惑,那么另外一方面,则是内部的倒逼。
首先是医保控费。从近几年的趋势看,谈判新增药品的平均降幅越来越大,比如2021年比2020年的平均降幅增加约10个点,
达到了61.71%;另外一方面,新药覆盖面越来越大,从获批到进医保的时间越来越短。根据毕马威统计,2021年新进医保的
64款药物中,有21款是当年刚刚获批的新药。进医保算是“豪赌”:以价换量成功,就如信达生物的PD-1,进医保的半年就
达到了未进之前的全年销售额;当然翻车的也很多。
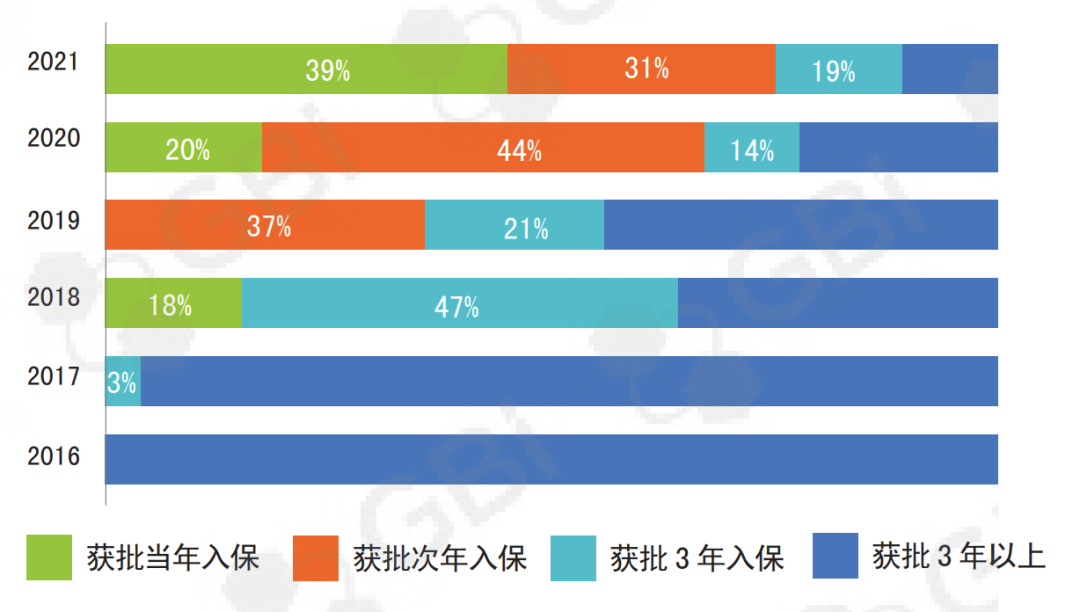
创新药更快纳入医保(来源:毕马威)
其次是同质化竞争,这一点可以和医保结合来看。以PD-(L)1举例,按照当下中国现存约500万的肿瘤患者来说,13款产品分一
分市场,不足以到“你死我活”的境地。但是医保只愿意给性价比最高的药品来买单,今年6月进行的医保目录调整则再次强调
了这一点——对准入方式进行调整,非独家药品要在医保支付标准下再互相竞价。进医保会被“大杀价”,不进医保,医院处方
这一环搞不好直接断掉,同质化药物的处境尴尬。
但国外是不会买me-too的,所以觉得可以me-better、best-in-class的药企为了更大的市场,或者说平衡自己早期的投入,开
始考虑远渡重洋开拓新市场。
2
达到彼岸的帆船
在出海大潮中,可圈可点的案例并不少。
从license-out来看,根据西南证券统计,从2020年至今,共有7款产品交易总金额突破10亿美元,其中百济神州更是以28.95亿
美元将TIGIT抗体欧司珀利单抗授予诺华,稳坐国内license-out交易额排名的头把交椅。
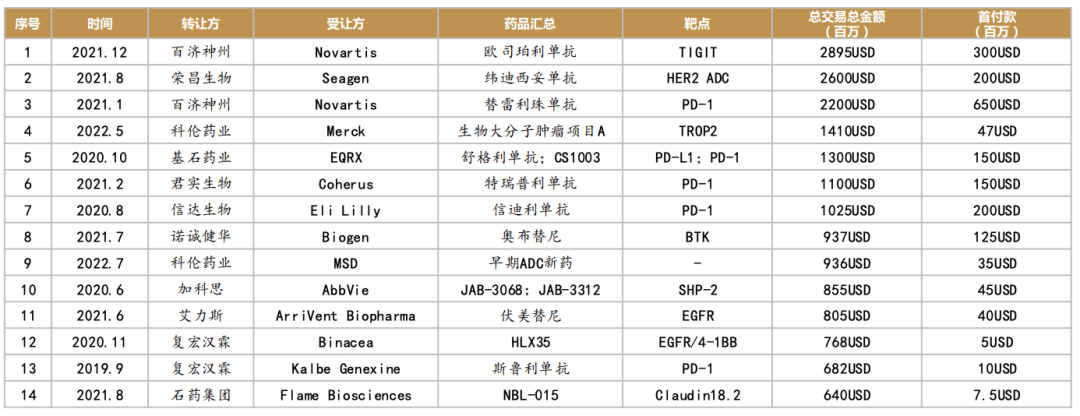
license-out交易额排名(来源:西南证券)
License-out的好处在于灵活、高效,企业可以依靠首付款+里程碑费用+销售来获得利润,很快补充药企资金,因此是当下出海
采用最多的模式。根据统计,2020年共有42项license-out,2021年增长为53项。
与license-out借船出海不同,自主出海则是将海外市场的临床开发、申报上市、生产和销售牢牢掌握在自己手里。自主出海虽然
对企业的资金链、研发团队、销售团队等要求高,但一旦成功,未来的想象空间更大。
泽布替尼就是一个成功例子。该药物是百济神州自主研发的BTK抑制剂,2019年11月获得FDA批准在美上市,实现了我国创新药
出海的“零的突破”。
截至目前,泽布替尼在美所获的批适应症有复发/难治性套细胞淋巴瘤、华氏巨球蛋白血症、边缘区淋巴瘤。从2021年销售额来看,
美国市场已经反超中国市场的销售收入。考虑到关键适应症慢性淋巴细胞白血病/小淋巴细胞淋巴瘤目前尚未获批,泽布替尼未来
还有很大的增长空间。
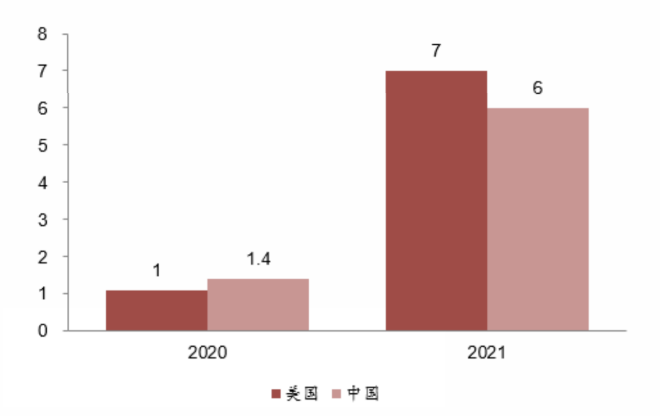
2020-2021年泽布替尼中美销售额(亿元,来源:西南证券)
传奇生物与强生旗下杨森制药的合作是第三种模式,即联合出海。2017年12月,双方就西达基奥仑赛签订协议,在大中华区以外,
双方平分投入与利润分配;大中华区以内,杨森和传奇生物则以30/70来划分费用和利润分配。
作为全球第二款上市的靶向BCMA的CAR-T产品,在其关键性研究CARTITUDE-1 Ib/II期中,西达基奥仑赛在既往接受过四种或
者以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤患者中显示出高达98%的总缓解率。
泽布替尼的成功有三点前提。首先产品是差异化的,“头对头”临床试验展现出有效性;另外,百济神州“血厚”,三地上市禁
得起全球多中心的“烧钱”;最后是百济拥有强大的海外团队,包括临床团队、法规注册团队等。
如果说暂无充足条件,像传奇生物选择与杨森联手出海,未尝不算是借力共成就的选择。当然还有license-out的选项,可以快
速回笼资金。简而言之,究竟选择哪种途径主要取决于产品的实力、对自我能力的认知。
3
失落与自省
根据西南证券统计,目前我国约有139个创新药正在海外进行233项临床试验,百济神州、恒瑞医药、加科思、康方生物、复星
医药、亚盛医药等均为出海管线数排名前列。
出海的门槛并不低,这也是为什么多为上市药企尝试出海。成功案例有,但失败案例更多。盘点2021年至今的出海受挫案例,
可根据原因大致可归为以下三类。
第一类,缺少代表美国患者人群的国际多中心临床试验数据。代表选手有恒瑞医药/万春药业的普那布林、信达生物/礼来的PD-1
产品信迪利单抗、和黄医药的索凡替尼。
恒瑞医药以首付款2亿元从万春药业引入普那布林。能被恒瑞医药的BD看上,普纳布林作为一款潜在FIC药物必然有其独特之处。
2020年6月,万春药业宣布普纳布林用于重度中性粒细胞减少症(CIN)的临床试验达到主要研究终点,同年该适应症先后获得
中国CDE和美国FDA的突破性疗法认定和优先评审资格。但在最后一刻,FDA还是拒绝批准普纳布林上市,认为其数据不足,需要补充数据。
信迪利单抗作为首个国产PD-1叩门FDA,引发业界高度关注。FDA肿瘤药物咨询委员会(ODAC)的审评会议中以14:1的投票
不建议批准其上市,认为其基于中国人群所做的III期结果不符合临床试验人群多样性以及无法代表美国人群,此外,应当以总生
存期(OS)而非替代终点无进展生存期(PFS)作为临床终点,且与已批准的PD-1疗法头对头进行试验。
和黄医药的索凡替尼是一款口服酪氨酸激酶抑制剂,已于2020年在中国获批上市,可用于晚期非胰腺/胰腺神经内分泌瘤治疗。
早在2019年,索凡替尼就凭借胰腺神经内分泌瘤适应症获得FDA授予的孤儿药资格。与信达生物不同,和黄医药还做了一项
美国桥接研究,在申请上市之前,和黄医药对中国III期研究和美国桥接试验这样的组合还是颇具信心,认为可以构成支持上市的
足够依据。但是FDA一纸回复函驳回,要求补做国际多中心临床试验。
第二类,海外试验受疫情影响,代表为康弘药业的康柏西普。
康柏西普是一款VEGF受体与人免疫球蛋白Fc段基因重组的融合蛋白,基于再生元/拜耳的阿柏西普改进研制而成,主要用于湿性
年龄相关性黄斑变性治疗。自2013年上市以来,至2021年累计销售额已超40亿元。
2018年,康弘药业启动了一项国际多中心试验,但受新冠疫情影响,大量受试者脱落、失访、超窗,使得符合试验给药防范的患者
不足入组病例的40%。更为核心的原因是试验结果不佳——68个试验中心里有一半以上的受试者视力在注射后较基线变化等于
甚至低于零,即治疗无效。在2021年4月,康弘药业宣布停止康柏西普的全球多中心试验。
第三类,现场核查受阻,代表为君实生物的特瑞普利单抗和亿帆医药的艾贝格司亭α注射液。
较之前两类的沉重,第三类就容易处理得多,反映到股市上,投资者反应也相对平稳。
在回复函中,FDA要求君实生物进行一项较为容易的质控流程变更,且表示由于疫情出行限制,暂时无法进行现场核查。7月,
特瑞普利单抗鼻咽癌适应症获得欧盟孤儿药资格认定,且FDA已经受理特瑞普利单抗鼻咽癌适应症上市申请。
2021年3月,亿帆医药子公司亿一生物向FDA提交了艾贝格司亭α注射液的上市申请,但审批结果并未如期公布,FDA表示因无法
进行现场核查,暂时推迟该药物的申请批复。不过根据业内人士推断,该药物的技术审批已经通过。
从仿走向创的过程必将经历阵痛期,失败在所难免,后进者应当吸取教训。除了客观因素影响以外,监管收紧之下,如何识别且
避开陷阱,是每一个出海的企业都需要认真思考的。为了出海而出海,很难说是一种负责任的行为。
(本文系转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问
题,请在本平台留言,我们将在第一时间删除)
联系地址:四川省成都市青羊区腾飞大道189号F区15栋9楼
服务热线:028-81717728
©和信医药 《互联网药品信息服务资格证》证书编号:(川)-非经营性-2022-0389
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息